How Llama Antibodies May Help us Fight Coronavirus

A study by Wrapp et al. just published in Cell shows antibodies from llamas block SARS and SARS-CoV-2, the virus that causes COVID-19 (Wrapp et al., 2020). Bien que cette découverte puisse ouvrir la voie à un traitement potentiel de la pandémie mondiale de coronavirus, elle a soulevé une interrogation chez de nombreuses personnes :
Why llama antibodies?
Le système immunitaire des camélidés est particulier.
La légende raconte qu’à la fin des années 1980, lors d’un cours de travaux pratiques à l’Université libre de Bruxelles, des étudiants ont été chargés d’extraire des anticorps du sérum sanguin humain. Lassés par cette expérience de routine, les étudiants ont commencé à chercher dans le congélateur des échantillons plus intéressants. Ils sont tombés par hasard sur un échantillon de sang de chameau, et ce qu’ils ont découvert a changé à jamais le domaine de l’immunothérapie. À côté des immunoglobulines habituelles se trouvaient des versions plus petites inattendues qui ne correspondaient à rien de ce que la science connaissait à l’époque. Les chercheurs ont approfondi leurs recherches et ont découvert que tous les camélidés (y compris les dromadaires, les lamas et les alpagas) ont un système immunitaire particulier (Gross, 2000).
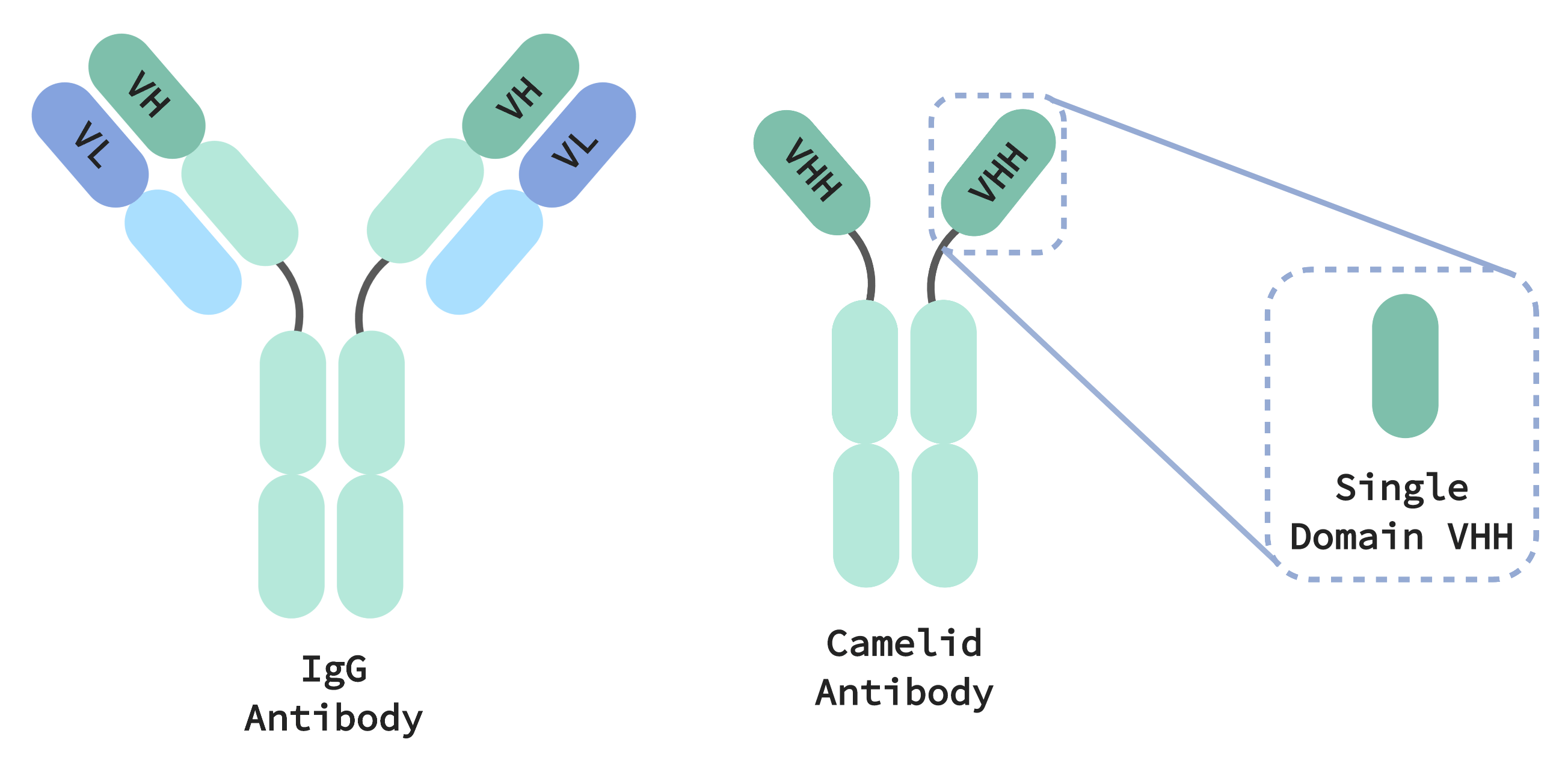
Le système immunitaire des camélidés génère des anticorps plus petits, à la fois plus simples et plus compacts que les immunoglobulines G (IgG) présentes chez tous les mammifères. Les IgG sont constituées de deux chaînes de protéines différentes, une lourde et une légère, qui doivent s’associer et coopérer pour détecter de manière spécifique une cible. Ce ciblage spécifique confère à notre système immunitaire une « mémoire » qui lui permet d’éliminer sélectivement et précisément les menaces pathogènes. La reconnaissance de la cible par les anticorps de camélidés, en revanche, ne nécessite qu’un seul domaine situé sur une seule chaîne de protéines, appelée VHH (équivalent de la région variable d’une chaîne lourde d’IgG). Les anticorps à base de VHH pouvant présenter des propriétés pharmaceutiques comparables à celles des IgG, ils constituent une thérapie prometteuse présentant plusieurs avantages par rapport à leurs équivalents plus volumineux et plus complexes.
Tout d’abord, la petite taille des anticorps de camélidés leur permet de se loger dans des espaces et de se lier ou de bloquer des parties de molécules qui seraient autrement inaccessibles aux anticorps IgG humains. Ils sont également plus stables thermiquement et chimiquement, ce qui confère aux traitements à base de VHH de bonnes capacités pour lutter contre les infections respiratoires, en les administrant par inhalation directement dans les voies respiratoires où l’infection est concentrée. En même temps, toutes ces propriétés confèrent aux molécules une longue durée de conservation.
La fabrication des produits thérapeutiques à base de VHH est également plus simple. Les anticorps IgG sont codés par deux gènes qui doivent être stockés, transfectés et exprimés en tant que paire spécifique afin de garantir leur fonctionnement. Si l’on multiplie cela par des milliers d’anticorps candidats, la fabrication d’IgG devient très vite un processus incroyablement complexe sur le plan logistique. En revanche, une fois qu’un anticorps VHH candidat est isolé, il ne doit être exprimé que par un seul gène, ce qui signifie que le suivi, le stockage et la réalisation d’expériences sur ces molécules représentent une dépense bien moindre. L’expression du seul domaine VHH peut également être réalisée, ce qui permet de produire des molécules thérapeutiques d’une taille dix fois inférieure à celle d’un anticorps IgG classique.
Des anticorps de lama pour le traitement du Coronavirus
L’année 2020 a été marquée par la pandémie de COVID-19. Deux molécules clés entrent en jeu lors de la liaison initiale du virus SARS-CoV-2 à une cellule humaine : la protéine S (« spicule ») de domaine de liaison au récepteur du virus, et l’enzyme de conversion de l’angiotensine 2 (ACE2) de la cellule hôte. La protéine de spicule se lie étroitement à l’ACE2, permettant au virus de pénétrer dans la cellule hôte. Le blocage de l’interaction de ces deux protéines constitue une cible thérapeutique importante. En théorie, un anticorps se liant étroitement à l’une ou l’autre des protéines neutraliserait les particules de coronavirus, empêchant le virus de pénétrer dans de nouvelles cellules.
Dans le cadre de la recherche d’anticorps de camélidés contre le SARS-CoV-2, Wrapp et al. ont immunisé des lamas avec une forme stabilisée de la protéine de spicule du SRAS, étroitement associée. Parmi les HVH générés par le système immunitaire des lamas figurait une molécule candidate qui se liait étroitement à la protéine de spicule et bloquait l’infection par le SARS.
Le SARS étant étroitement lié au SARS-CoV-2, les chercheurs ont ensuite testé la capacité de l’anticorps à interagir avec la protéine de spicule équivalente du SARS-CoV-2. Tandis que l’interaction initiale est demeurée faible, une version plus forte a été créée en la fusionnant avec une partie d’une IgG humaine. Cette molécule de fusion a été capable de neutraliser efficacement le SARS-CoV-2.
Compte tenu de la pénurie de traitements prophylactiques et thérapeutiques actuellement disponibles pour traiter l’épidémie de coronavirus, on espère que ces produits thérapeutiques à base de camélidés contribueront à la fois à la recherche et au traitement du COVID-19.
Avis d’expert
« Chez Twist Bioscience, nous nous intéressons de près aux lamas car leur système immunitaire contient des anticorps qui ne possèdent qu’une chaîne lourde. Ces anticorps VHH ou à domaine unique sont de petite taille, faciles à produire et se lient à des sites uniques, ou épitopes, sur des cibles pathologiques », souligne Aaron Sato, Ph.D., Directeur scientifique de Twist Biopharma, une division de Twist Bioscience.
« En gardant ces molécules à l’esprit, nous avons développé des banques d’exposition sur phage d’anticorps VHH synthétiques provenant de la diversité des séquences naturelles du lama », souligne le Dr Sato. « Ces banques permettent d’identifier les anticorps VHH sans immuniser les lamas et de réduire le temps de recherche ! »
Récemment, l’équipe de Twist Biopharma dirigée par le Dr Sato a utilisé ses banques synthétiques à domaine unique provenant de lamas pour la recherche d’anticorps VHH neutralisant l’ACE2 en moins de 6 semaines. Un grand nombre de ces anticorps VHH ont révélé une liaison significative avec le récepteur et ont empêché l’ACE2 de se lier à la protéine S1 du SARS-CoV-2. Cette étude de cas a fait apparaître la capacité de ces banques à traiter rapidement une autre cible thérapeutique importante pour la pandémie de COVID-19.
Cliquez ici pour en savoir plus sur les banques synthétiques d’anticorps VHH de Twist Biopharma et sur la méthode employée pour développer des produits thérapeutiques candidats pour le COVID-19.
References
Wrapp et al., Structural Basis for Potent Neutralization of Betacoronaviruses by Single-Domain Camelid
Antibodies, Cell (2020), https://doi.org/10.1016/j.cell.2020.04.031
Michael Gross, One reason to get the hump, The Guardian (2000), accessed 26th mai 2020, https://www.theguardian.com/science/2000/sep/14/technology1
Photo de couverture par Jessica Knowlden sur Unsplash
Qu’en pensez-vous ?
J’aime
bien
Je n’aime pas
J’aime beaucoup
Je suis surpris(e)
C’est intéressant
