Les alternatives à Cas9 renforcent les applications CRISPR de nouvelle génération
Améliorer le rendement des cultures. Élimination de la malaria chez les moustiques. Traiter des maladies génétiques auparavant incurables. Sept ans après les débuts de CRISPR-Cas9 comme ciseau génomique, il est devenu difficile de répondre à la question « que peut faire Cas9 » ? En fait, que ne peut pas faire Cas9 ? Si l’on retire son activité nucléasique, Cas9 devient une plateforme modulaire pour le contrôle de la transcription, la modification épigénétique, le marquage génomique et l’édition de bases, entre autres applications. L’énorme succès biotechnologique de Cas9 a stimulé les efforts visant à élargir la boîte à outils CRISPR pour y inclure d’autres nucléases CRISPR, permettant ainsi la prochaine génération d’applications CRISPR.
Les enzymes associées à CRISPR (Cas) existent chez la plupart des archées et de nombreuses bactéries en tant que composante de leur immunité adaptative En 2015, quelques années seulement après que Cas9 ait été réutilisé pour la première fois comme modificateur de gènes, les systèmes Cas ont été organisés en 2 classes, 5 types et 16 sous-types sur la base de leurs caractéristiques distinctives. Aujourd’hui, le système de classification comprend 2 classes, 6 types et 33 sous-types (Makarova et al., 2020). Ce changement a été motivé en partie par la recherche de nouveaux systèmes de classe 2 qui pourraient être réutilisés pour la manipulation des génomes à la Cas9. Il s’agit notamment de l’édition d’ADN Cas12a (Cpf1) et des éditions d’ARN basés sur Cas13.
Les Argonautes, un groupe de protéines guidées par l’acide nucléique qui se distingue principalement des systèmes CRISPR-Cas, ont eu mauvaise presse en 2016 lorsqu’un article très médiatisé a été retiré après que plusieurs groupes indépendants ont échoué à confirmer leurs prétendues capacités d’édition de gènes (Gao et al., 2016). Néanmoins, les Argonautes méritent d’être mentionnés ici, ne serait-ce que pour signaler une application pour laquelle ils sont mieux adaptés que les systèmes CRISPR.
Ci-dessous, nous mettons en évidence quelques-uns des développements les plus transformateurs de la technologie CRISPR (et des Argonautes), établis par les experts de Twist Bioscience.
Cas12 simplifie les cribles combinatoires
De nombreux processus biologiques, tels que les métastases tumorales, impliquent des interactions génétiques complexes qui ne peuvent être entièrement résolues par une approche de neutralisation unique. Bien que Cas9 soit la référence pour les applications de criblage par knock-out unique, son application dans les cribles combinatoires a été paralysée par ses capacités de multiplexage insuffisantes. Plusieurs groupes indépendants ont récemment optimisé le système CRISPR de type V Cas12a (Cpf1) afin de proposer une alternative améliorée à Cas9 pour l’édition combinatoire de gènes à l’échelle (DeWeirdt et al., 2020 ; Gier et al., 2020).
En quoi Cas12a est-il préférable à Cas9 pour les cribles combinatoires ? Cas12a peut traiter des réseaux d’ARN CRISPR (ARNc) sans RNase III et ARN trans-activateur (ARNt), composants nécessaires à Cas9 pour accomplir la même tâche. Comme Cas9 ne peut pas traiter les réseaux ARNc par lui-même, les guides Cas9 doivent généralement être exprimés dans des cassettes d’expression séparées, une par guide. Les éléments répétitifs des guides Cas9 multiplexés les rendent sujets à la recombinaison et au découplage lors de la délivrance lentivirale, de la PCR et du séquençage profond. Ces facteurs peuvent compliquer la constitution de banques, le clonage et l’analyse.
Avec Cas12a, des oligonucléotides contenant plusieurs ARNc peuvent être synthétisés et facilement clonés dans des vecteurs lentiviraux pour des applications de criblage combinatoire. En outre, les éléments répétitifs des vecteurs guides Cas12a multiplexés sont comparativement courts et plus tolérants aux modifications de séquence, ce qui rend les guides Cas12a multiplexés moins vulnérables à la recombinaison et au découplage tout au long du processus de criblage (DeWeirdt et al., 2020 ; Gier et al., 2020). Un oligonucléotide de 300mères de Twist Bioscience peut coder 3 ou 4 guides simultanément.
Bien que Cas12a soit un excellent multiplexeur, il présente certaines limites, notamment une spécificité plus restrictive du PAM (5’-TTTV) et une efficacité de mutation plus faible par rapport à Cas9. Ces paramètres ont été perfectionnés par l’ingénierie des protéines guidée par la structure de Cas12a d’Acidaminococcus (AsCas12a ; Kleinstiver et al., 2019), aboutissant à une enzyme modifiée appelée AsCas12a améliorée (enAsCas12a) qui contient de multiples mutations ponctuelles dans des résidus importants pour la reconnaissance du PAM. Outre l’élargissement de sa spécificité PAM (qui inclut désormais TTYN, VTTV et TRTV, entre autres), enAsCas12a s’est avérée de façon inattendue améliorer l’efficacité de l’édition en la multipliant par deux en moyenne par rapport à AsCas12a. L’efficacité d’AsCas12a a encore été améliorée par l’ajout de multiples séquences de localisation nucléaire et la clarification des règles relatives aux ARNr ciblés et non ciblés (DeWeirdt et al., 2020 ; Gier et al., 2020).
Les systèmes CRISPR de type VI s’intéressent à l’ARN
L’interférence ARN (ARNi) utilisant des ARN courts appelés en « épingle à cheveux » (shRNA) est une stratégie bien établie d’élimination des gènes qui fait appel à une voie de traitement de l’ARN endogène pour détériorer les ARNm cellulaires. Cependant, l’ARNi souffre d’effets non ciblés et d’une efficacité d’élimination non uniforme. Le problème de spécificité a été résolu par l’interférence CRISPR, une approche d’élimination qui utilise une Cas9 sans nucléase fusionnée au domaine répresseur de transcription KRAB. Malgré cela, l’interférence CRISPR et l’ARNi ne parviennent pas toujours à éliminer leurs cibles de manière efficace en cas d’expression élevée du gène central ou de transcription médiocre de l’ARN court appelé « épingle à cheveux », respectivement.
C’est là qu’intervient RfxCas13d (CasRx), une nucléase CRISPR guidée par l’ARN et ciblant l’ARN. CasRx n’a peut-être pas été le premier éditeur d’ARN découvert, mais des comparaisons avec d’autres systèmes Cas13 (LwaCas13a et PspCas13b) et des méthodes existantes démontrent que CasRx induit l’élimination la plus importante sur de nombreux gènes, et ce avec une grande spécificité. Qui plus est, une variante dCasRx, sans nucléase, peut être ciblée sur les éléments cis des pré-ARNm afin de réguler leur épissage. Pour mettre en évidence cette caractéristique, Konermann et al. (2018) ont ciblé dCasRx sur un silencieux d’épissage intronique pour rectifier l’épissage pathologique de l’ARNm codant pour la protéine Tau dans un modèle neuronal de démence frontotemporale.
En raison de la préférence accordée aux ARN monocaténaires, le ciblage des systèmes Cas13 en général peut être entravé par la structure secondaire de l’ARN (Abudayyeh et al., 2017). Cependant, leur capacité à provoquer des changements transitoires en ciblant l’ARN sur le génome, et leur absence de contraintes de séquence en font des outils d’édition du transcriptome attrayants pour des applications expérimentales et thérapeutiques.
Les systèmes CRISPR-Cas de classe 1 diversifient la combinaison de systèmes CRISPR
Alors que les systèmes CRISPR-Cas de classe 2, tels que Cas9, Cas12 et Cas13, continuent de dominer le milieu de l’ingénierie des génomes, les systèmes CRISPR-Cas de classe 1 commencent à attirer l’attention en raison de leurs propriétés de clivage uniques et de leur composition multiprotéique. Les plus courants sont les systèmes de type I, qui combinent l’hélicase Cas3 avec un complexe de protéines Cas accessoires appelé CRISPR- associated complex for antiviral defense, ou « Cascade ».
Si Cas9 et Cas12a sont des ciseaux génomiques, alors Cas3 est un broyeur génomique. Plutôt que de produire de petits indels comme Cas9, Cas3 provoque un spectre de grandes délétions génomiques - allant de 0,5 à 100 kb de longueur - en amont des sites génomiques ciblés (Dolan et al., 2019). Cette caractéristique promet de nouvelles applications de criblage à haut débit grâce auxquelles il est possible de générer des banques de mutants de délétion avec comparativement moins de guides que les systèmes CRISPR de classe 2.
The Cascade complex alone also provides a modular platform for RNA-guided transcriptional activation and repression. Site-directed repression can be achieved using crRNAs in cas3-deleted E. coli (Luo et al., 2015; Rath et al., 2015) or in mammalian cells expressing exogenous Cascade proteins (Pickar-Oliver et al., 2019; Chen et al., 2020).
For gene activation, transcriptional activator domains need to be fused to one or more members of Cascade. Chen et al. (2020) obtained the best results when the synthetic VPR (VP64-p65-Rta) activator domain was fused to Csy3, the backbone component of Pseudomonas aeruginosa Cascade (PaeCascade) that interacts with the crRNA. Because multiple Csy3 proteins participate in the formation of the PaeCascade complex, multiple transcriptional effector domains can be recruited to a single Cascade complex. This strategy does not necessarily work for other class 1 systems, however, as the fusion of transcriptional effectors to Cas7 of EcoCascade (its Csy3 equivalent) failed to elevate transcription at targeted loci (Pickar-Oliver et al., 2019).
La nature multiprotéique de Cascade est pratique pour construire des dispositifs modulaires de contrôle transcriptionnel, mais elle signifie également que plusieurs protéines effectrices doivent être co-exprimées. Cela pourrait empêcher l’utilisation des systèmes de classe 1 pour certaines applications.
Des loci CRISPR inhabituels révèlent des transposases associées à CRISPR
Most CRISPR loci contain genes for site-directed nucleases. For example, CRISPR loci encoding type I systems typically contain cas3, which encodes the endonuclease effector of these Cas systems. Recent bioinformatic analyses, however, revealed CRISPR loci containing Tn7-like transposon genes instead of Cas endonuclease genes. From these loci, two CRISPR-associated transposon systems have been characterized: the class 2 type V-K effector Cas12k (Strecker et al., 2019) and the class 1 type I-F Cascade complex (Halpin-Healy et al., 2020). Instead of cleaving DNA, these Cas systems can insert large segments of DNA into the genome in a site-directed and nuclease-independent fashion.
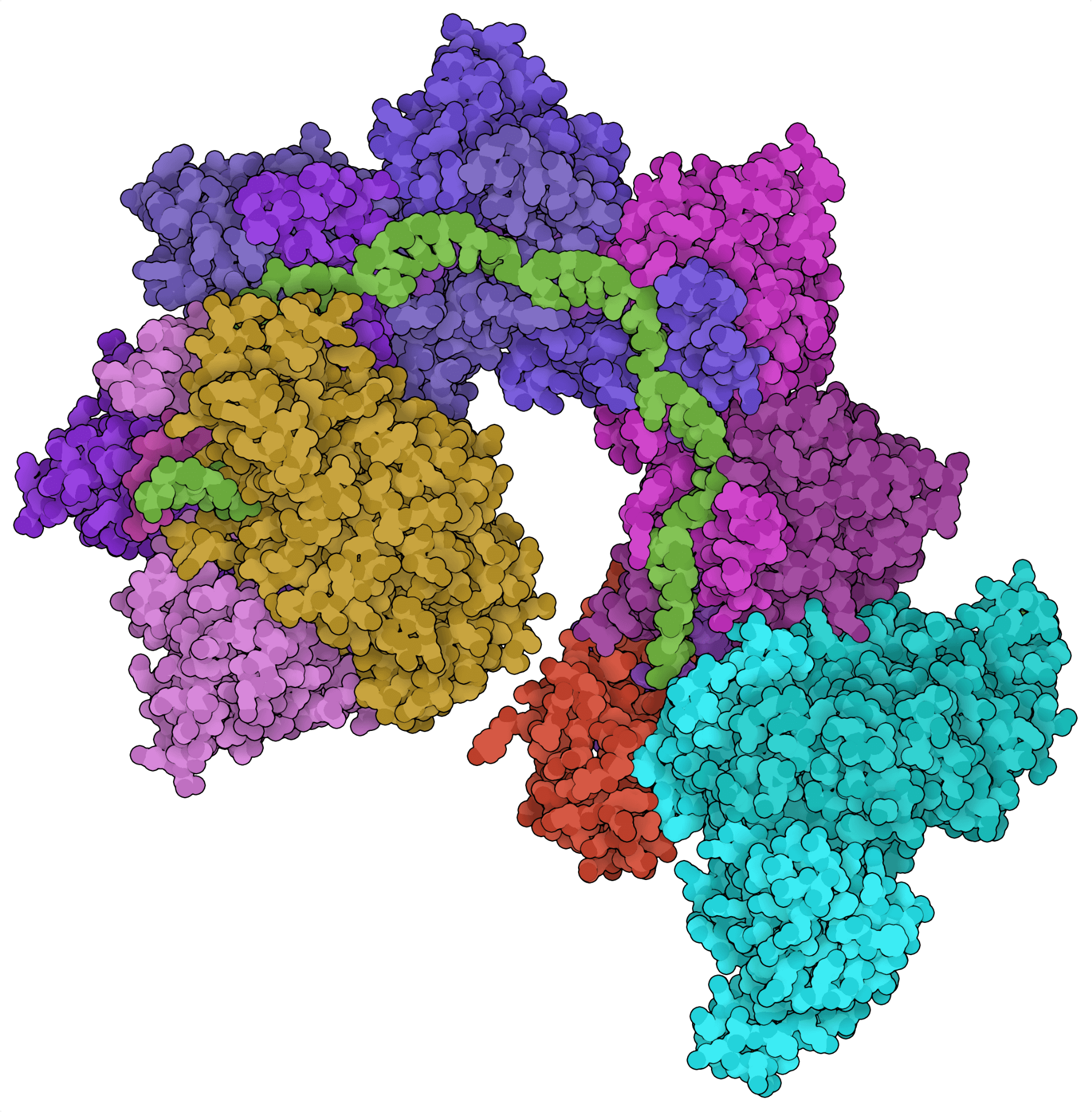
Les approches traditionnelles de knock-in de gène basées sur CRISPR dépendent de la réparation dirigée par l’homologie après une cassure de l’ADN dirigée vers un site, processus très peu performant. Les transposons associés à CRISPR récemment identifiés offrent une solution potentiellement plus efficace en permettant la transposition de grands fragments d’ADN. Les transposases associées à CRISPR pourraient être utilisées pour remplacer des exons défectueux ou générer des cellules T à récepteur antigénique chimérique (CAR, chimeric antigen receptor). Bien que prometteuses, les activités transposasiques de ces systèmes n’ont pas encore été démontrées dans des cellules eucaryotes.
Les argonautes facilitent le stockage de données sur l’ADN
Sometimes the best alternative to Cas9 is not a CRISPR system at all. This is true for nick-based DNA data storage, which requires a nicking enzyme to encode information in native DNA. DNA has been proposed as an alternative to current silicon-based storage media because of its relatively high durability and enormous storage density. To further push the limits of the information storage density of DNA, researchers have recently developed a nick-based approach (Tabatabaei et al., 2020).
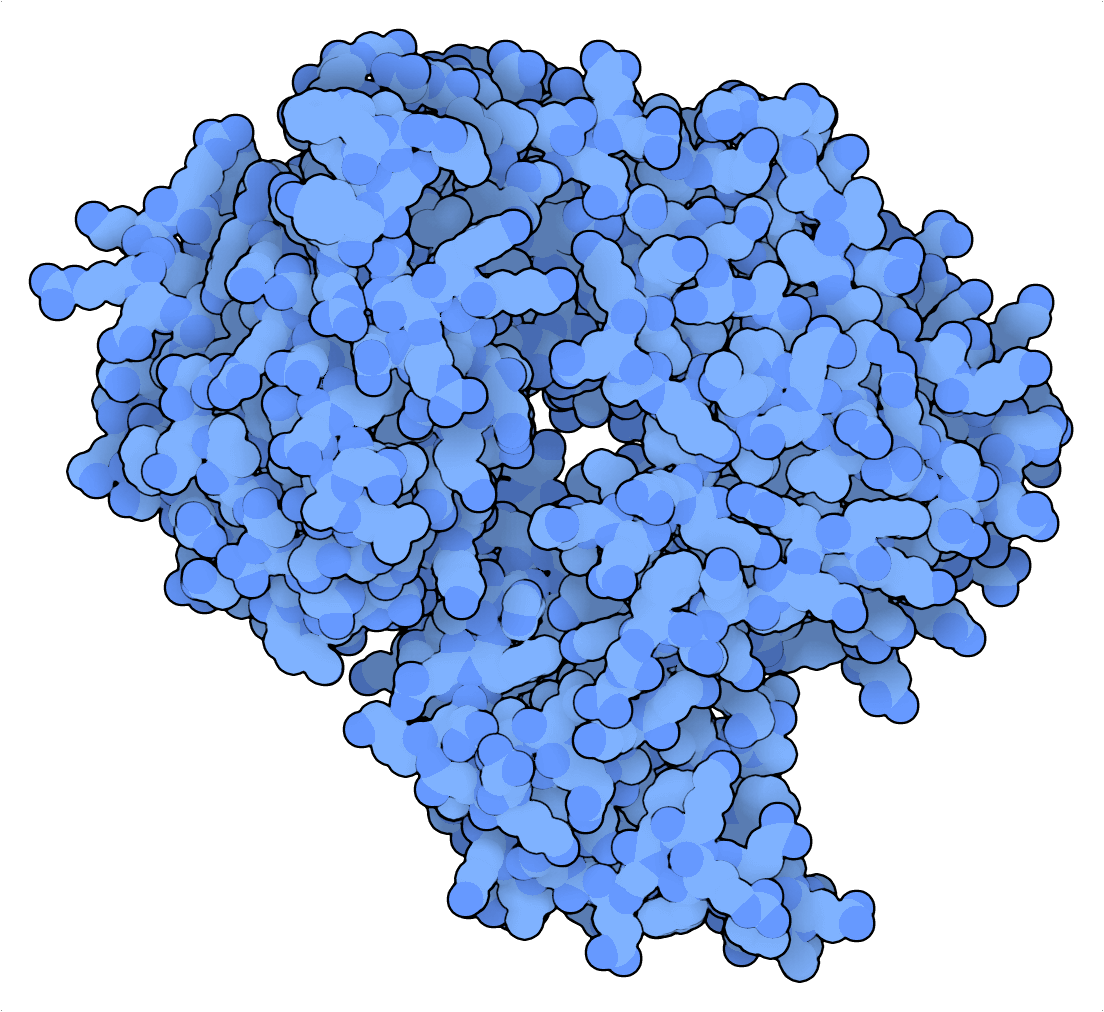
Tabatabaei et al. (2020) ont exploité les propriétés favorables de la coupure simple brin de PfArgo pour créer un dispositif d’écriture de l’ADN qui transforme un brin d’ADNdb en une « carte perforée ». Ici, l’information binaire est codée dans une configuration de coupures simple brin, qui peut être lue en dénaturant les fragments d’ADN simple brin. Ces fragments peuvent ensuite être séquencés par séquençage de nouvelle génération ou nanopore et mis en correspondance avec les cartes perforées de référence pour retrouver les informations codées. Pour mettre en évidence la densité de stockage exceptionnelle de cette stratégie, Tabatabaei et al. (2020) ont compressé un document JPEG de 329 kilobytes (Ko) du Lincoln Memorial en un fichier ADN de 14 Ko !
En ce qui concerne le stockage de données sur l’ADN basées sur les coupures à simple brin, les propriétés de coupure de la nickase Cas9 ne sont pas à la hauteur de celles de l’Argonaute (PfAgo) Pyrococcus furiosus. Alors que la première est une enzyme à rotation unique qui s’appuie sur des interactions ARN-ADN instables et limitées par des PAM pour le ciblage, la seconde peut induire des centaines de coupures simple brin par enzyme en utilisant des guides d’ADN courts qui ne sont limités par aucune séquence de ciblage spécifique.
Ce ne sont là que quelques-unes des applications rendues possibles par les protéines guidées par les acides nucléiques des familles CRISPR et Argonaute. Pour en savoir plus sur la manière d’élargir votre champ d’action CRISPR, parlez avec un membre de l’équipe.
Protein illustrations were generated from PDB structures using Illustrate, a non-photorealistic biomolecular illustration tool (Goodsell et al., 2019).
References
Abudayyeh OO, Gootenberg JS, Essletzbichler P, Han S, Joung J, Belanto JJ, Verdine V, Cox DBT, Kellner MJ, Regev A, Lander ES, Voytas DF, Ting AY, Zhang F (2017) RNA targeting with CRISPR-Cas13. Nature 550:280-284.
Chen Y, Liu J, Zhi S, Zheng Q, Ma W, Huang J, Liu Y, Liu D, Liang P, Songyang Z (2020) Repurposing type I-F CRISPR-Cas system as a transcriptional activation tool in human cells. Nat Commun 11:3136.
DeWeirdt, PC, Sangree, AK, Hanna, RE et al. (2020) Genetic screens in isogenic mammalian cell lines without single cell cloning. Nat Commun 11, 752.
Dolan AE, Hou Z, Xiao Y, Gramelspacher MJ, Heo J, Howden SE, Freddolino PL, Ke A, Zhang Y (2019) Introducing a Spectrum of Long-Range Genomic Deletions in Human Embryonic Stem Cells Using Type I CRISPR-Cas. Mol Cell 74:936-950 e935.
Gao F, Shen XZ, Jiang F, Wu Y, Han C (2016) DNA-guided genome editing using the Natronobacterium gregoryi Argonaute. Nat Biotechnol 34:768-773.
Gier, RA, Budinich, KA, Evitt, NH et al. (2020) High-performance CRISPR-Cas12a genome editing for combinatorial genetic screening. Nat Commun 11, 3455
Goodsell, DS, Autin, L, Olson, AJ (2019) Illustrate: Software for Biomolecular Illustration. Structure 27:1716-1720.e1
Halpin-Healy TS, Klompe SE, Sternberg SH, Fernandez IS (2020) Structural basis of DNA targeting by a transposon-encoded CRISPR-Cas system. Nature 577:271-274.
Kleinstiver BP, Sousa AA, Walton RT, Tak YE, Hsu JY, Clement K, Welch MM, Horng JE, Malagon-Lopez J, Scarfo I, Maus MV, Pinello L, Aryee MJ, Joung JK (2019) Engineered CRISPR-Cas12a variants with increased activities and improved targeting ranges for gene, epigenetic and base editing. Nat Biotechnol 37:276-282.
Konermann S, Lotfy P, Brideau NJ, Oki J, Shokhirev MN, Hsu PD (2018) Transcriptome Engineering with RNA-Targeting Type VI-D CRISPR Effectors. Cell 173:665-676 e614.
Luo ML, Mullis AS, Leenay RT, Beisel CL (2015) Repurposing endogenous type I CRISPR-Cas systems for programmable gene repression. Nucleic Acids Res 43:674-681.
Makarova KS et al. (2020) Evolutionary classification of CRISPR-Cas systems: a burst of class 2 and derived variants. Nat Rev Microbiol 18:67-83.
Pickar-Oliver A, Black JB, Lewis MM, Mutchnick KJ, Klann TS, Gilcrest KA, Sitton MJ, Nelson CE, Barrera A, Bartelt LC, Reddy TE, Beisel CL, Barrangou R, Gersbach CA (2019) Targeted transcriptional modulation with type I CRISPR-Cas systems in human cells. Nat Biotechnol 37:1493-1501.
Rath D, Amlinger L, Hoekzema M, Devulapally PR, Lundgren M (2015) Efficient programmable gene silencing by Cascade. Nucleic Acids Res 43:237-246.
Strecker J, Ladha A, Gardner Z, Schmid-Burgk JL, Makarova KS, Koonin EV, Zhang F (2019) RNA-guided DNA insertion with CRISPR-associated transposases. Science 365:48-53.
Tabatabaei SK, Wang B, Athreya NBM, Enghiad B, Hernandez AG, Fields CJ, Leburton JP, Soloveichik D, Zhao H, Milenkovic O (2020) DNA punch cards for storing data on native DNA sequences via enzymatic nicking. Nat Commun 11:1742.
Qu’en pensez-vous ?
J’aime
bien
Je n’aime pas
J’aime beaucoup
Je suis surpris(e)
C’est intéressant
